1. Protein tyrosine phosphatase 1B
Protein tyrosine phosphatase 1B (PTP1B) là một trong những enzym thuộc nhóm các protein tyrosine phosphatases (PTPs) chịu trách nhiệm cho quá trình đề phosphoryl hoá [1]. Nó được tinh chế từ nhau thai người, được mô tả vào năm 1988, được kết tinh vào năm 1994 [2] và nhiều nghiên cứu vẫn đang được tiến hành để xác định cơ chế điều hòa của nó. PTP1B đóng vai trò quan trọng bằng cách ức chế con đường truyền tín hiệu thông qua các thụ thể insulin và leptin (điều hòa ngược insulin (negative insulin regulation) và tập hợp các tín hiệu liên quan tới leptin (leptin signal system)). Trong trường hợp insulin và leptin, PTP1B khử phospho hóa thụ thể insulin (IR) và cơ chất chính của nó, protein IRS hoặc tyrosine kinase JAK2 (Janus kinase 2). PTP1B cũng đóng một vai trò trong sự tăng sinh tế bào. Do đó, enzyme này đang thu hút rất nhiều sự quan tâm cho các ứng dụng có thể có trong bệnh béo phì, tiểu đường và ung thư.
Protein PTP1B tự nhiên bao gồm 435 amino acid và có một số vùng (Hình 1):
- Từ amino acid 30 - 278: là miền xúc tác của loại phosphatase tương ứng với phần đầu N (màu xanh lục trong Hình 1).
- Từ amino acid 279 - 401: là vùng điều hòa giàu prolin (màu tím trong Hình 1).
- Từ amino acid 401 - 435: là miền định vị màng cho phép gắn enzym vào mặt tế bào chất của mạng lưới nội chất và tương ứng với phần đầu C (miền ER màu cam trong Hình 1).
    |
 |
| Hình 1: Sơ đồ biểu diễn cấu trúc miền của PTP1B [3] |
Do đó, càng nhiều chất ức chế chứa các nhóm thế có thể tương tác với tất cả các vùng hoạt động của PTP1B thì hiệu quả và độ chọn lọc sẽ càng tăng.
2. Cơ chế hoạt động của enzym PTP1B
Cysteine 215, có mặt trong vị trí hoạt động của enzyme PTP1B, xúc tác cho sự thủy phân phosphate. Quá trình xúc tác này bao gồm 2 giai đoạn (Hình 2):
Giai đoạn 1 là sự tấn công nucleophin vào photphat của chất nền bởi nguyên tử lưu huỳnh thiolate của cysteine 215. Đồng thời, aspartic acid 181 gần với vị trí xúc tác tạo điều kiện thuận lợi cho quá trình proton hóa. Vì vậy, quá trình này hình thành một chất trung gian photphat và sự tách ra của chất nền khử phospho.
Giai đoạn 2 là quá trình thủy phân chất trung gian photphat. Điều này dẫn đến việc giải phóng photphat và phục hồi phosphatase. Quá trình thủy phân này xảy ra thông qua glutamine Gln262 tạo ra một phân tử nước và aspartic acid Asp181 hoạt động như một bazơ liên hợp.
    |
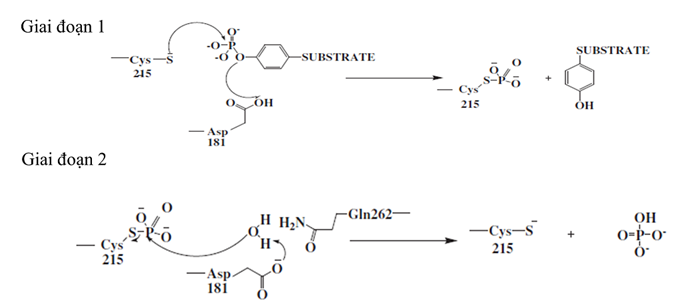 |
| Hình 2: Cơ chế xúc tác của PTP1B |
Để các cơ chất hoạt động, chúng phải có khả năng chạm tới bề mặt của mạng lưới nội chất và có liên quan đến bốn cơ chế (có thể hoạt động độc lập hoặc liên kết): hiện tượng oxy hóa, phosphoryl hóa, tổng hợp và phân giải protein.
3. Hoạt tính sinh học của enzym PTP1B
PTP1B có liên quan đến việc điều chỉnh nhiều quá trình sinh học. Do đó, chúng có thể tham gia vào biểu hiện của một số bệnh. Ba tác động chính hiện được mô tả cho PTP1B đó là tác động đối với quá trình trao đổi chất, tác động đối với quá trình sinh khối u và tác động đối với các bệnh thoái hóa thần kinh [3].
3.1. Tác động đối với quá trình trao đổi chất
PTP1B kiểm soát tiêu cực các con đường truyền tín hiệu liên quan đến chuyển hóa insulin và leptin và có thể được sử dụng trong điều trị bệnh tiểu đường loại 2 (tiểu đường không phụ thuộc insulin) và béo phì.
Bệnh tiểu đường tương ứng với sự gia tăng kéo dài nồng độ glucose trong máu (tăng đường huyết). Trong trường hợp bệnh tiểu đường loại 2, có sự giảm độ nhạy cảm của tế bào với insulin (tình trạng kháng insulin), đặc biệt là do béo phì hoặc lối sống ít vận động. Để đáp ứng nhu cầu insulin tăng lên, các tế bào tiết insulin của tuyến tụy sản xuất nhiều insulin hơn (hyperinsulinism) cho đến khi chúng không thể đáp ứng được nữa hoặc cuối cùng trở nên cạn kiệt. Việc sản xuất insulin sau đó trở nên không đủ dẫn đến sự tích tụ glucose trong máu (tăng đường huyết). Nói cách khác, insulin được sản xuất với số lượng không đủ trước nhu cầu gia tăng.
Về mặt phân tử và trong các điều kiện sinh lý, sự kích thích bằng cách gắn insulin với thụ thể của nó dẫn đến quá trình tự phosphoryl hóa và kích hoạt thụ thể insulin loại 1 (IRS-1) bằng cách phosphoryl hóa tyrosine. Sau đó, các bước đầu tiên này dẫn đến việc kích hoạt phosphatidyl-inositol loại 3 (PI3K) và AKT, sau đó cho phép chuyển vị chất vận chuyển glucose. PTP1B làm suy giảm tầng kích hoạt này bằng cách khử phospho IRS-1 và điều được mong đợi ở bệnh tiểu đường loại 2 là ức chế quá trình khử phospho này (Hình 3, màu đỏ).
    |
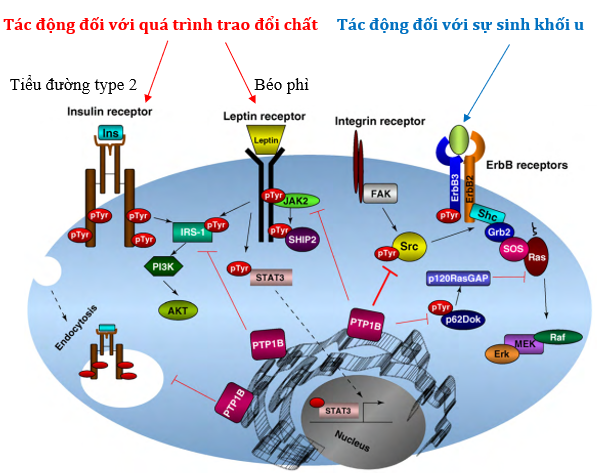 |
| Hình 3: Tác động đối với quá trình chuyển hóa và sinh ung thư của PTP1B [3] |
Leptin là một hormone peptide điều chỉnh lượng chất béo dự trữ trong cơ thể và sự thèm ăn bằng cách kiểm soát cảm giác no. Hormone này được phát hiện vào năm 1994 và đã được nghiên cứu kể từ khi leptin có chức năng điều chỉnh cân nặng và ngăn ngừa béo phì ở cả động vật và con người. Leptin truyền đến não thông tin rằng cơ thể có đủ chất béo dự trữ, giúp kiềm chế sự thèm ăn, báo hiệu cho cơ thể đốt cháy calo và ngăn ngừa việc ăn quá nhiều. Ngược lại, khi mức leptin thấp, não không được truyền thông tin và sinh ra cảm giác đói, từ đó, cảm giác thèm ăn của tăng lên, cơ thể sẽ sinh ra thèm ăn và hạn chế đốt năng lượng để giữ trữ. Như vậy, sự tiết leptin đáng kể gây ra quá trình phân giải mỡ, ức chế quá trình tạo mỡ và tăng độ nhạy insulin.
Về mặt phân tử, sự liên kết của leptin với thụ thể của nó cho phép quá trình phosphoryl hóa các tyrosine của protein kinase JAK2 và kích hoạt yếu tố phiên mã STAT-3. Hai yếu tố này là mục tiêu trực tiếp của PTP1B. PTP1B làm suy yếu tầng kích hoạt này bằng cách khử phospho hóa JAK2, điều được mong đợi trong các trường hợp béo phì (Hình 3, màu đỏ).
3.2. Tác động đối với sự sinh khối u
PTP1B cũng có thể đóng một vai trò trong quá trình sinh ung thư (Hình 3, màu xanh lam). Thật vậy, PTP1B có sự kiểm soát tích cực đối với gen ErbB2 (còn gọi là HER2) mã hóa cho các thụ thể của yếu tố tăng trưởng biểu bì tham gia vào các cơ chế truyền tín hiệu nội bào kiểm soát sự tăng trưởng, sự sống sót, sự bám dính, di cư cũng như sự biệt hóa của tế bào. Thực tế là protein này là tác nhân kích hoạt một loạt các phản ứng sinh học khiến nó trở thành nguồn gốc của sự tăng sinh tế bào. Ở một số bệnh ung thư vú (20-30%), gen này được khuếch đại do đột biến và dẫn đến tăng số lượng thụ thể trên bề mặt tế bào. Sự biểu hiện quá mức của HER2 do đột biến này sau đó đi kèm với sự gia tăng của các tế bào ung thư. PTP1B có thể hoạt động trên tầng kích hoạt tế bào bằng cách khử phospho hóa các chất trung gian như p62Dok, p120RasGAP, có khả năng kích hoạt con đường Ras-MAPK liên quan đến sự tăng sinh tế bào. Do đó, PTP1B có thể điều chỉnh sự tăng sinh tế bào và có thể đóng một vai trò trong quá trình phát sinh ung thư. Tương tự, PTP1B có thể đóng vai trò trong tiền ung thư tyrosine-protein kinase Src bằng cách khử phospho hóa nó, dẫn đến vô hiệu hóa các GTPase nhỏ như Ras và Rac tham gia vào quá trình tăng sinh tế bào.
Như vậy, sự ức chế PTP1B đã được khuyến nghị như một chiến lược quan trọng để tăng cường độ nhạy insulin ở các tế bào khác nhau và thực tế này được hỗ trợ bởi dữ liệu di truyền của con người. Chất ức chế PTP1B cải thiện độ nhạy của thụ thể insulin và có khả năng chữa các bệnh liên quan đến kháng insulin. Trong những năm qua, các chất ức chế PTP1B đang được coi là một mục tiêu hấp dẫn để điều trị bệnh đái tháo đường type 2 và do đó, các thư viện chất ức chế PTP1B đang được đề xuất là thuốc trị đái tháo đường hiệu quả [5].
4. Các chất ức chế PTP1B
PTP1B là mục tiêu điều trị hiệu quả để kiểm soát bệnh tiểu đường, do vậy, đã có nhiều nghiên cứu được thực hiện để phát triển và xác định các chất ức chế PTP1B như một mục tiêu điều trị mới để kiểm soát bệnh tiểu đường type 2 và các rối loạn chuyển hóa liên quan [6].
4.1. Các hợp chất tổng hợp
Nhiều hợp chất tổng hợp đã được tổng hợp và 139 hợp chất được mô tả trong công bố của Thareja, 2010 [7] cho thấy nhiều kiểu hợp chất có khả năng tương tác với PTP1B. Đó là các hợp chất thuộc loại thiazolidinedione, các dẫn xuất photpho bị ion hóa bắt chước phosphotyrosyl peptide, các dẫn xuất isothiazolidinone, benzofurans và biphenyl benzothiophenes, các hợp chất chứa vanadi, dẫn xuất của axit 2-oxalylamino benzoic, 1,2-naphthoquinones, dẫn xuất formylchromone, các hợp chất tương tự pyridazine, acetophenones,… (Bảng 1).
Bảng 1: Cấu trúc và hoạt động của các hợp chất tổng hợp ức chế PTP1B [7]
Theo bảng 1, các hợp chất có khả năng tích điện sẽ được ưu tiên làm chất ức chế, nhưng chúng khó có thể đi qua màng sinh lý. Do đó, vấn đề là tìm ra các hợp chất ức chế chọn lọc, mạnh, đủ khả dụng sinh học ở dạng uống. Mặc dù có nhiều nghiên cưu, nhưng hiện tại, mới có một số thuốc ức chế PTP1B được sử dụng. Hợp chất đầu tiên phải kể đến là chất ức chế ISIS-113715. Nó là chất ức chế antisense được phát triển bởi công ty ISIS Pharmaceuticals Inc. để quản lý bệnh tiểu đường loại 2 [8-11]. Gần đây, Lantz [12] đã công bố rằng, trodusquemine (Hình 4) là một chất ức chế PTP1B trung tâm và ngoại vi hiệu quả, đồng thời cải thiện nồng độ insulin và leptin. Mới đây, hợp chất này còn được xem như một bước đột phá trong điều trị các bệnh liên quan đến tim mạch.
    |
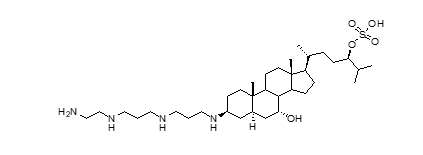 |
| Hình 4: Cấu trúc của trodusquemine |
4.2. Các hợp chất tự nhiên từ thực vật, nấm và bọt biển
Các hợp chất tự nhiên luôn cũng là một trong số những hợp chất có hoạt tính ức chế PTP1B. Chúng ta có thể kể đến các hợp chất thuộc flavonoid (flavonol, flavan, chalcone, flavanone), có hoặc không có chuỗi isoprenyl và prenyl, các hợp chất isoquinolinic alkaloid (berberine, papaverine), các dẫn xuất arylbenzofuran với chuỗi isoprenyl, dẫn xuất acid cinnamic và chlorogenic, diterpenes, triterpenes, anthraquinones… Một số hợp chất có nguồn gốc từ nuôi cấy nấm như dephostatin (Streptomyces sp.), từ bọt biển như hyrtiosal (Hyrtios erectus) cũng được đánh giá khă năng ức chế PTP1B (bảng 2).
Bảng 2: Các hợp chất tự nhiên ức chế PTP1B [7]
4.3. Các hợp chất tự nhiên từ địa y
Các hợp chất được phân lập từ địa y cũng đã được thử nghiệm khả năng ức chế PTP1B (Bảng 3). Năm 2009, hai dẫn xuất loại diphenyl ete (sakisacaulon A đã metyl hóa, lobarine đã metyl hóa) và ba hợp chất loại desidone (acid lobaric và 2 dẫn xuất metyl hóa và methoxyl hóa của nó) từ loài địa y Stereocaulon alpinum đã cho thấy khả nnawg ức chế PTP1B [13]. Vào năm 2012, bằng sáng chế cho một hợp chất có nguồn gốc từ quá trình thủy phân kiềm của acid lobaric, lobarin, đã được chấp nhận nhằm điều trị bệnh tiểu đường loại 2 và bệnh béo phì [14,15]. Lobarin cũng là một hợp chất được tìm thấy tự nhiên trong chi Stereocaulon.
Các hợp chất kiểu depside cũng đã được thử nghiệm như atranorine [16], acid lecanoric [13], brialmontine [17] với IC50 trên enzyme lần lượt là 63,5 µM, 31 µM, 14 µM. Các hợp chất phenol đơn nhân chẳng hạn như methyl orsellinate (IC50 > 200 µM), ethylhaematommate (IC50 > 200 µM), 2,6-dihydroxy-4-methoxy-3-methylacetophenone (IC50 > 200 µM), β- Methyl orcinol carboxylate (IC50 = 51,5 µM) cũng đã được thử nghiệm nhưng không cho thấy hoạt tính đáng kể. Hợp chất kiểu tridepside, acid gyrophoric, được phân lập từ Umbilicaria antarctica và triterpene, 22-hopanediol, được phân lập từ Lecidella carpathica cho thấy IC50 tương tự như acid ursolic, là hợp chất đối chứng (IC50 = 3 µM) và hoạt động như chất ức chế không cạnh tranh [13,17].
Các diterpen kiểu furan đã được phân lập từ địa y thuộc chi Huea sp. và một trong những hợp chất, hueafuranoid A, cho thấy khả năng ức chế PTP1B (loại không cạnh tranh) với IC50 là 13,9 µM [18].
Bảng 3: Các hợp chất tự nhiên phân lập từ địa y và khả năng ức chế PTP1B [7]
Nhìn chung, hoạt tính ức chế PTP1B của các hợp chất có nguồn gốc tự nhiên yếu hơn hoạt tính của các hợp chất tổng hợp. Tuy nhiên, do sự tương đồng về cấu trúc giữa các protein liên quan chặt chẽ, rất khó xác định các loại thuốc phân tử nhỏ có đủ đặc hiệu. Vì vậy, tìm kiếm các thuốc đặc hiệu ức chế PTP1B mà không ức chế các thành viên khác thuộc nhóm PTPs, giúp giảm hoạt động của PTP1B mà không có tác dụng khác đối với các protein liên quan chặt chẽ vẫn là mục tiêu của các nhà khoa học.
Tài liệu tham khảo
1. Elchebly M (1999). Un nouvel espoir dans le traitement du diabète de type 2 et de l’obésité. Médecine/sciences 15: 1187–1188.
2. Barford D, Flint A, Tonks N (1994). Crystal structure of human protein tyrosine phosphatase 1B. Science (80- ) 263: 1397–1404.
3. Yip S-C, Saha S, Chernoff J (2010). PTP1B: a double agent in metabolism and oncogenesis. Trends Biochem Sci 35: 442–449.
4. Thareja S, Aggarwal S, Bhardwaj TR, Kumar M (2010). Protein Tyrosine Phosphatase 1B Inhibitors: A Molecular Level Legitimate Approach for the Management of Diabetes Mellitus. Med Res Rev 32: 459–517.
5. Hidayat Hussain, Ivan R Green, Ghulam Abbas, Sergazy M Adekenov, Wahid Hussain and Iftikhar Ali (2018). Protein tyrosine phosphatase 1B (PTP1B) inhibitors as potential anti-diabetes agents: patent review (2015-2018). Expert opinion on therapeutic patents, Vol. 29, No. 9, 689-702.
6. Sobhia ME, Paul S, Shinde R, et al. Protein tyrosine phosphatase inhibitors: a patent review (2002-2011). Expert Opin Ther Pat. 2012;22:125–153.
7. Thareja S, Aggarwal S, Bhardwaj TR, Kumar M (2010) Protein Tyrosine Phosphatase 1B Inhibitors : A Molecular Level Legitimate Approach for the Management of Diabetes Mellitus. Med Res Rev 32: 459–517.
8. Swarbrick MM, Havel PJ, Levin A a, Bremer A a, Stanhope KL, et al. (2009) Inhibition of protein tyrosine phosphatase-1B with antisense oligonucleotides improves insulin sensitivity and increases adiponectin concentrations in monkeys. Endocrinology 150: 1670–1679.
9. Zinker B a, Rondinone CM, Trevillyan JM, Gum RJ, Clampit JE, et al. (2002) PTP1B antisense oligonucleotide lowers PTP1B protein, normalizes blood glucose, and improves insulin sensitivity in diabetic mice. Proc Natl Acad Sci U S A 99: 11357–11362.
10. Waring JF, Ciurlionis R, Clampit JE, Morgan S, Gum RJ, et al. (2003) PTP1B antisense-treated mice show regulation of genes involved in lipogenesis in liver and fat. Mol Cell Endocrinol 203: 155–168.
11. Gum RJ, Gaede LL, Koterski SL, Heindel M, Clampit JE, et al. (2003) Increases Insulin-Dependent Signaling in ob / ob Mice. Diabetes 52: 21–28.
12. Lantz K a, Hart SGE, Planey SL, Roitman MF, Ruiz-White I a, et al. (2010) Inhibition of PTP1B by trodusquemine (MSI-1436) causes fat-specific weight loss in diet-induced obese mice. Obesity (Silver Spring) 18: 1516–1523.
13. Seo C, Choi Y-H, Ahn JS, Yim JH, Lee HK, et al. (2009) PTP1B inhibitory effects of tridepside and related metabolites isolated from the Antarctic lichen Umbilicaria antarctica. J Enzyme Inhib Med Chem 24: 1133–1137.
14. Lim JH, Kim IC, Kim DG, Han SJ, Lee HS, et al. (2012) Lobarin for treating diabetes and obesity.
15. Yim JH, Kim IC, Han SJ, Lee HS, Datta BH, et al. (2014) Pharmaceutical and food composition for preventing or treating diabetes or obesity.
16. Seo C, Sohn JH, Ahn JS, Yim JH, Lee HK, et al. (2009) Protein tyrosine phosphatase 1B inhibitory effects of depsidone and pseudodepsidone metabolites from the Antarctic lichen Stereocaulon alpinum. Bioorg Med Chem Lett 19: 2801–2803.
17. Seo C, HanYim J, Kum Lee H, Oh H (2011) PTP1B inhibitory secondary metabolites from the Antarctic lichen Lecidella carpathica. Mycology 2: 18–23.
18. Cui Y, Yim JH, Lee D-S, Kim Y-C, Oh H (2012) New diterpene furanoids from the Antarctic lichen Huea sp. Bioorg Med Chem Lett 22: 7393–7396.